國家藥監局發布《醫療器械臨床試驗檢查要點及判定原則》
日期:
2018-12-06
瀏覽次數:
67
來源:國家藥監局
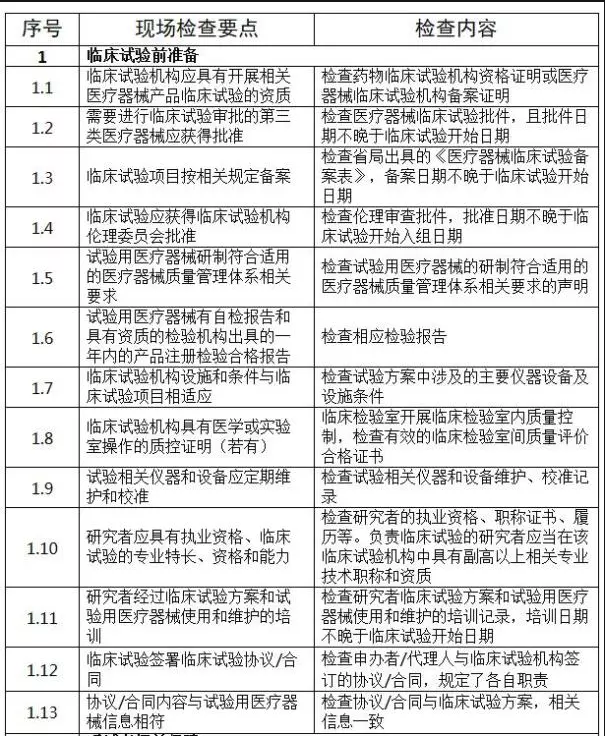
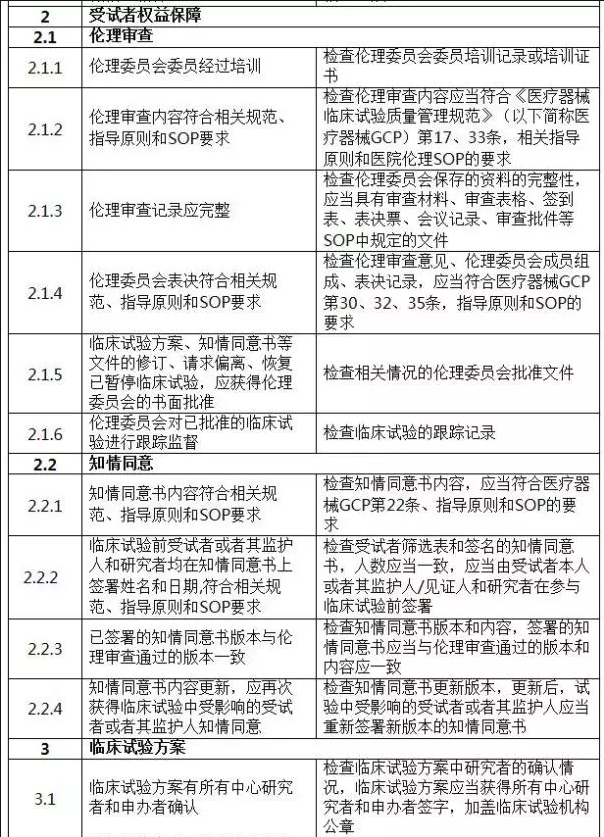
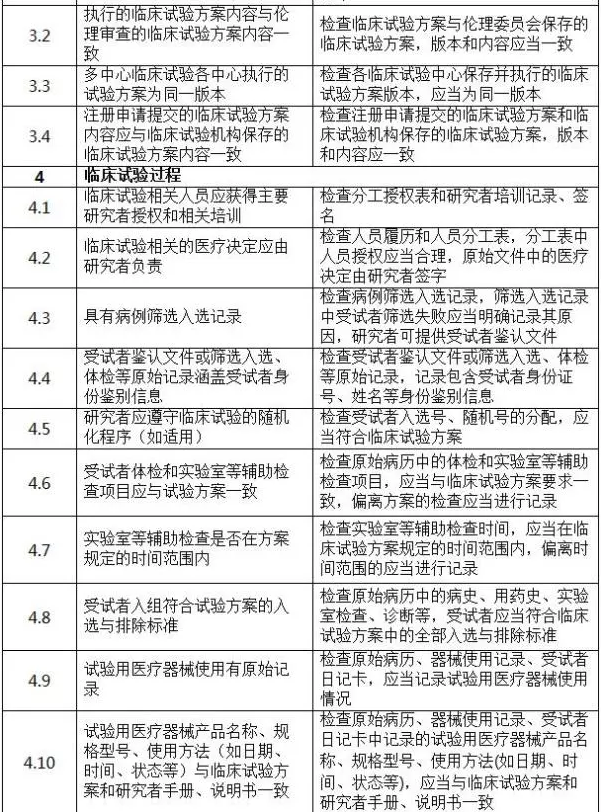
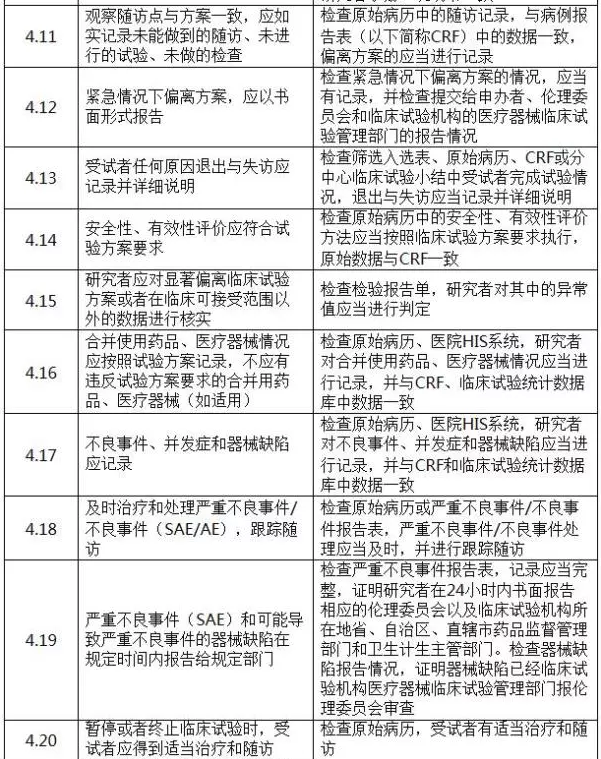
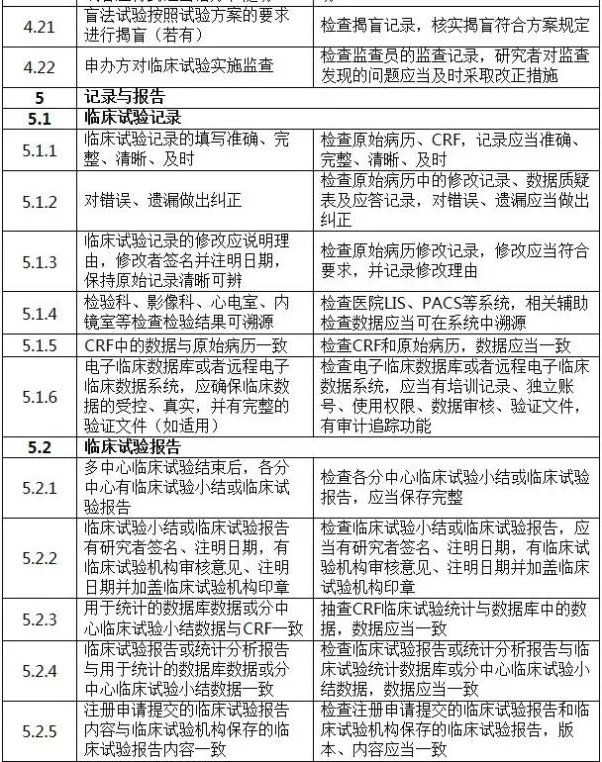
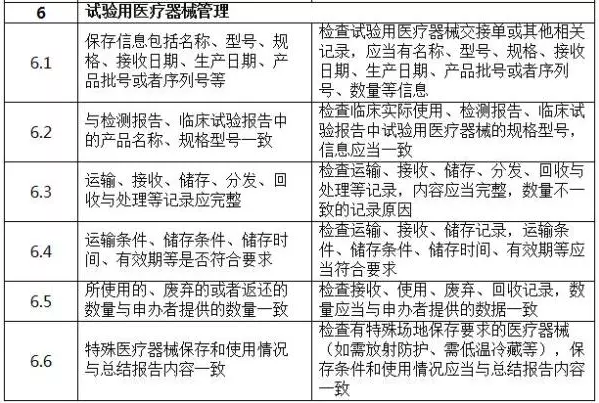
二、判定原則
根據檢查發現的問題,檢查結果按以下原則判定:
(一)有以下情形之一的,判定為存在真實性問題:
1.編造受試者信息、主要試驗過程記錄、研究數據、檢測數據等臨床試驗數據,影響醫療器械安全性、有效性評價結果的;
2.臨床試驗數據,如入選排除標準、主要療效指標、重要的安全性指標等不能溯源的;
3.試驗用醫療器械不真實,如以對照用醫療器械替代試驗用醫療器械、以試驗用醫療器械替代對照用醫療器械,以及以其他方式使用虛假試驗用醫療器械的;
4.瞞報與臨床試驗用醫療器械相關的嚴重不良事件和可能導致嚴重不良事件的醫療器械缺陷、使用方案禁用的合并用藥或醫療器械的;
5.注冊申請的臨床試驗報告中數據與臨床試驗機構保存的臨床試驗報告中的數據不一致,影響醫療器械安全性、有效性評價結果的;
6.注冊申請的臨床試驗統計分析報告中數據與臨床試驗統計數據庫中數據或分中心臨床試驗小結中數據不一致,影響醫療器械安全性、有效性評價結果的;
7.其他故意破壞醫療器械臨床試驗數據真實性的情形。
(二)未發現真實性問題的,但臨床試驗過程不符合醫療器械臨床試驗相關規定要求的,判定為存在合規性問題。
(三)未發現上述問題的,判定為符合要求。